|
Medikamente: ACE-Hemmer |
|
ACE-Hemmer sind Arzneistoffe, die insbesondere in der Therapie des Bluthochdruckes (Hypertonie) und der chronischen Herzinsuffizienz Anwendung finden. Sie sind Hemmstoffe (Inhibitoren) des Angiotensin-konvertierenden Enzyms (Angiotensin Converting Enzyme = ACE), das ein Teil einer Blutdruck regulierenden Kaskade ist (Renin-Angiotensin-Aldosteron-System). ACE-hemmende Inhaltsstoffe wurden zuerst in Schlangengiften gefunden.
Die wichtigsten in der Therapie verwendeten Vertreter sind Captopril, Enalapril, Lisinopril und Ramipril. Diese zählen auch auf Grund ihrer grossen therapeutischen Bedeutung zu den umsatzstärksten Arzneistoffen überhaupt.
Chemie
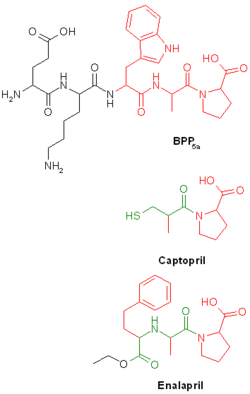
ACE-Hemmer, wie Captopril, Enalapril und ihre Nachfolgersubstanzen sind strukturverwandt mit dem aus dem Schlangengift der brasilianischen Jararaca-Lanzenotter (Bothrops jararaca) isolierten Pentapeptid BPP5a (von „Bradykinin potenzierendes Peptid“; Sequenz DKWAP, siehe Abbildung). Die in BPP5a vorkommende Tripeptidsequenz Tryptophan-Alanin-Prolin wurde als wirksame Komponente erkannt (in Abbildung rot dargestellt)[1].
Da BPP5a und das Tripeptid im Körper sehr schnell abgebaut werden, wurden zahlreiche Modifikationen am Molekül vorgenommen, um die Wirkdauer zu verlängern. Dazu wurde die WAP-Sequenz gegen eine ähnliche aber stabilere FAP-Sequenz ausgetauscht. Die Einbringung einer bernsteinsäure- oder glutarsäureanalogen Struktur (in Abbildung grün dargestellt) brachte weitere Stabilität und eine Verstärkung der Hemmwirkung am Angiotensin Converting Enzyme[2].
Darüber hinaus sind bis auf Captopril und Lisinopril alle therapeutisch genutzten ACE-Hemmer Prodrugs, die erst im Körper aktiviert werden. Im Falle von Enalapril und Ramipril geschieht dies durch Abspaltung der Ethylgruppe durch Esterasen, wodurch die Wirkform, das Enalaprilat bzw. Ramiprilat, mit einer freien Carboxylgruppe entsteht, welche dann das Zink des ACE komplexieren kann.
Pharmakologie
Anwendungsgebiete
ACE-Hemmer werden überwiegend zur Therapie des Bluthochdrucks eingesetzt. Hierfür gelten sie einzeln (Monotherapie) und in Kombination mit anderen Blutdrucksenkern (Kombinationstherapie, insbesondere mit Diuretika oder Calciumantagonisten) als Mittel der ersten Wahl. Bei Bluthochdruckformen, die mit einem erniedrigten Renin-Spiegel im Blutplasma einhergehen (z.B. Conn-Syndrom) zeigen ACE-Hemmer hingegen nur unzureichende Wirksamkeit.
Daneben haben sich ACE-Hemmer in zahlreichen grossen klinischen Studien auch bei der chronischen Herzinsuffizienz als lebensverlängernd erwiesen. Dies beruht wahrscheinlich auf der Senkung der Nachlast und Abnahme der Wandspannung des Herzmuskels durch die Abnahme von Angiotensin II.
Auch nach Herzinfarkten werden ACE-Hemmer eingesetzt.
Eine weitere Indikation der ACE-Hemmer ist die diabetische Nephropathie. Derzeit besitzt lediglich Captopril eine Zulassung dafür.
Wirkmechanismus
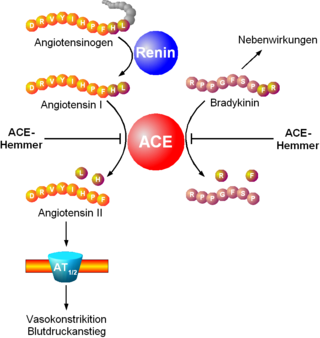
Der Wirkungsmechanismus der ACE-Hemmer beruht in einer Hemmung des Angiotensin umsetzenden Enzyms. Dieses Enzym hat im Organismus zwei Hauptaufgaben. Einerseits ist es für die Synthese des gefässverengend wirksamen Octapeptids (Peptid aus 8 Aminosäuren) Angiotensin II aus seiner inaktiven Vorstufe, dem Decapeptid (10 Aminosäuren) Angiotensin I unter Abspaltung der zwei C-terminalen Aminosäuren zuständig. Andererseits hemmt es den Abbau des Mediators Bradykinin in inaktive Produkte.
Die Hemmung des Angiotensin Converting Enzyme hat eine Abnahme der Angiotensin-II-Konzentration an den Angiotensinrezeptoren (AT1 und AT2) zur Folge. Primär sinkt dadurch der Blutgefässtonus, und der Blutdruck nimmt ab. Sekundär führt die Abnahme des Angiotensin-II-Spiegels zu einer Verringerung der Aldosteron-Freisetzung aus der Nebennierenrinde und somit zu einer Beeinflussung des Wasserhaushalts (siehe auch Renin-Angiotensin-Aldosteron-System). Auf zellulärer Ebene kann ein Rückgang der durch Angiotensin II vermittelten mitogenen Effekte an Fibroblasten und Myozyten des Herzens, die insbesondere nach einem Herzinfarkt zu ungünstigen Veränderungen (Remodeling) führen, beobachtet werden.
Bei Nierenerkrankungen wie der diabetischen Nephropathie führen ACE-Hemmer zu einer verminderten Proteinausscheidung (Proteinurie) und verhindern ein Fortschreiten der Erkrankung (Nephroprotektion).
Die Hemmung des Abbaus von Bradykinin führt hingegen zu dessen Kumulation und damit verbundenen Nebenwirkungen.
Molekularer Wirkmechanismus
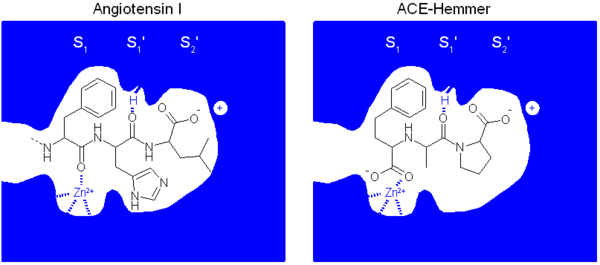
Auch der molekulare Wirkmechanismus der ACE-Hemmer konnte aufgeklärt werden. Er beruht auf der Ähnlichkeit der ACE-Hemmer zu einem Peptidkettenende des Angiotensin I. Dadurch werden ACE-Hemmer vom Angiotensin Converting Enzyme fälschlich für das physiologische Substrat Angiotensin I gehalten. Im Gegensatz zum physiologischen Substrat werden sie aber nicht vom Enzym umgesetzt und blockieren dieses. Wichtig für die Bindung des Liganden sind drei Wechselwirkungen:
- eine Komplexierung des Zink-Ions des ACE. Dies ist in der Regel eine Carboxylgruppe oder beim Captopril eine Thiolgruppe
- eine elektrostatische Wechselwirkung zwischen dem K511 des ACE und der Carboxylatfunktion des Prolins des Liganden
- eine Wasserstoffbrückenbindung zwischen H353 des ACE und dem Carbonyl des Alanins bzw. Lysins des Liganden
Pharmakokinetik
Entsprechend ihrer chemischen Differenzen unterscheiden sich die ACE-Hemmer untereinander in der Pharmakokinetik. Die Mehrzahl der derzeit verfügbaren ACE-Hemmer sind Prodrugs. Das heisst, dass sie nach einer 20%igen (Ramipril) bis fast 100%igen Aufnahme (Resorption) durch Enzyme im Körper aktiviert werden müssen (siehe Chemie). Lediglich Captopril und Lisinopril benötigen diesen Aktivierungsschritt nicht. Maximale Plasmaspiegel der Wirkformen werden nach 1 bis 8 Stunden erreicht. Die Plasmahalbwertszeiten schwanken zwischen 2 (Captopril) und 40 Stunden (Spirapril). Entsprechend variiert auch die Wirkdauer (8 bis 48 Stunden). Alle ACE-Hemmer werden überwiegend über die Niere ausgeschieden. Fosinopril, Moexipril und Spirapril zeigen darüber hinaus eine relevante biliäre Exkretion (Ausscheidung über die Galle)[3].
Nebenwirkungen
Die wichtigsten Nebenwirkungen sind trockener Husten, Hypotonie, akutes Nierenversagen, Hyperkaliämie, und Probleme während der Schwangerschaft (unten einzeln erklärt). Diese Nebenwirkungen sind allen ACE-Hemmern gemeinsam.
Die meisten Nebenwirkungen von ACE-Hemmern werden mit einem verlangsamten Abbau und Anreicherung von Bradykinin durch ACE-Hemmer in Verbindung gebracht. Dazu zählen Hautreaktionen, wie z.B. Exantheme (0,1 - 1%) und Nesselsucht (0,01 - 0,1%). Schwere allergische Hautreaktionen werden hingegen nur sehr selten beobachtet (< 0,01%). Die als charakteristisch für ACE-Hemmer geltende Nebenwirkung, das Auftreten angioneurotischer Ödeme, kann ebenfalls nur selten beobachtet werden (0,01 -0,1%).
Auch die Mehrzahl der die Atemwege betreffenden Nebenwirkungen kann mit einer Kumulation von Bradykinin in Verbindung gebracht werden.
Dazu zählt in erster Linie trockener Husten (in den ersten 3 Monaten bei 5 bis 35 % der Patienten). Bei trockenem Husten sollte man, falls der Patient es tolerieren kann, bis zu 3 Monaten warten, ob diese Nebenwirkung ohne weiteres Zutun rückläufig wird, was oft der Fall ist. Ansonsten ist gegen diese Nebenwirkung nur das Absetzen des ACE-Hemmers wirksam (oder, in Fällen wo dies geeignet sein sollte, die Dosisreduktion).[4] [5]
Auch Heiserkeit und Halsschmerz (0,1 - 1%) treten auf. Asthmaanfälle und Atemnot können ebenfalls, wenn auch selten, auftreten (0,01 - 0,1%).
Unter der Therapie mit ACE-Hemmern kann es bradykininunabhängig zu einer Hypotonie, d.h. zu einer zu starken Blutdrucksenkung kommen. In Folge dessen können gelegentlich Schwindel, Kopfschmerz und Benommenheit beobachtet werden (0,1 - 1%). Von schweren Herz-Kreislaufereignissen, wie Angina Pectoris, Herzinfarkt und Synkope, wurde nur in Einzelfällen berichtet. Dieser Nebenwirkung kann man mit Vorsichtsmassnahmen vorbeugen: bei Flüssigkeitsmangel zuerst Flüssigkeitsgabe und Absetzen von Diuretika (falls der Patient diese einnimmt), dann ACE-Hemmer beginnen; bei Patienten mit Herzinsuffizienz mit einer geringeren Dosierung als anvisiert anfangen, dann die Dosis steigern. Diese Nebenwirkung tritt bevorzugt bei Patienten mit Herzinsuffizienz auf.[6]
Durch Eingriff in den Wasser- und Elektrolythaushalt können gelegentlich funktionelle Nierenfunktionsstörungen beobachtet werden (0,1 - 1%). Eine Proteinurie (Ausscheidung von Proteinen im Harn) bis hin zu akutem Nierenversagen wurde hingegen nur selten beobachtet (0,01 - 0,1%). Eine akutes Nierenversagen wird fast nur bei Risikopatienten, d.h. mit bilateraler Nierenarterienstenose, hypertonischer Nephrosklerose, Herzinsuffizienz, polyzystischer Nierenerkrankung oder vorher existierenden chronischem Nierenversagen, beobachtet. Das Nierenversagen ist oft reversibel.[7] [8]
Eine klinisch relevante Hyperkaliämie kommt nur bei < 10 % vor; bei fast allen Patienten aber kann der Arzt eine geringe, klinisch nicht relevante Erhöhung der Kalium-Spiegel beobachten.[9] Die klinisch relevante Hyperkaliämie entsteht sehr oft bei Patienten mit bereits vorhandenem Nierenversagen, gleichzeitiger Einnahme von kaliumsparenden Diuretika (z.B. Triamteren), NSAR (Nichtsteroidale Antirheumatika), schwerer Herzinsuffizienz und bei älteren Patienten. Niedrige Dosen von ACE-Hemmern führen nicht zu dieser Nebenwirkung.
Durch die Wirkungen auf das Renin-Angiotensin-Aldosteron-System mit Abnahme der Aldosteron-Ausschüttung lässt sich diese weitere unerwünschte Wirkung von ACE-Hemmern erklären: Aldosteron verstärkt die Na- und Wasser-Wiederaufnahme in der Niere, während es die Kalium-Ausscheidung fördert. Bei verminderter Konzentration von Aldosteron kommt es zum gegenteiligen Effekt: erhöhte Natrium und Wasser-Ausscheidung der Niere, während Kalium vermehrt im Körper verbleibt. So kann es zu einer, vor allem für das Herz, gefährlichen Hyperkaliämie kommen. Selten kommt es auch zu einer Hyponatriämie.
Kontraindiziert in der Schwangerschaft: Da ACE-Hemmer in der Schwangerschaft u.a. Wachstums- und Knochenbildungsstörungen beim Kind verbunden mit einer erhöhten Sterblichkeit hervorrufen können, dürfen ACE-Hemmer in dieser Zeit nicht eingenommen werden und sollten durch andere geeignete therapeutische Massnahmen ersetzt werden[10][11].
Wechselwirkungen
ACE-Hemmer verstärken die Blutbild verändernden Nebenwirkungen immunsuppressiv wirkender Arzneistoffe (Immunsuppressiva, Zytostatika und Glucocorticoid). Ebenso verstärken ACE-Hemmer die Blutzucker senkende Wirkung oraler Antidiabetika und Insulin.
Durch Eingriff in den Wasser- und Elektrolythaushalt kann die Ausscheidung von Lithium verlangsamt werden. Ebenso kann eine Verstärkung des Anstiegs des Kaliumspiegels bei kombinierter Anwendung mit kaliumsparenden Diuretika beobachtet werden.
Bei Kombination mit anderen blutdrucksenkenden Arzneimitteln sollte eine verstärkte Blutdrucksenkung berücksichtigt werden. Synergistische Effekte, die auch therapeutisch ausgenutzt werden, treten insbesondere mit Diuretika und mit Calciumkanalhemmern auf. Eine verringerte Blutdruck senkende Wirkung der ACE-Hemmer konnte vereinzelt nach Einnahme kochsalzreicher Kost beobachtet werden[10][11].
Arzneistoffe
Derzeit sind in Deutschland folgende ACE-Hemmer als Arzneistoff zugelassen:
- Benazepril (Cibacen®, Generika)
- Captopril (Lopirin®, Tensobon®, Generika)
- Cilazapril (Dynorm®)
- Enalapril (Xanef®, Pres®, Generika)
- Fosinopril (Fosinorm®, Dynacil®)
- Imidapril (Tanatril®)
- Lisinopril (Acerbon®, Coric®, Generika)
- Moexipril (Fempress®)
- Perindopril (Coversum®, Preterax®)
- Quinapril (Accupro®, Generika)
- Ramipril (Delix®, Vesdil®, Generika)
- Spirapril (Quadropril®)
- Trandolapril (Gopten®, Udrik®)
- Zofenopril (Bifril® , Zofenil®)
Geschichte
Der Grundstein für die Entwicklung der ACE-Hemmer wurde 1956 mit der Aufklärung der Funktion des Angiotensin Converting Enzyme (ACE) durch Leonard T. Skeggs Jr. gelegt[12]. Die Bedeutung dieses Enzyms für die Blutdruckregulation wurde anfangs noch unterschätzt.
14 Jahre nach der Entdeckung des Angiotensin Converting Enzyme (1970) wurde durch den Pharmakologen Sergio H. Ferreira herausgefunden, dass das Gift der Jararaca-Lanzenotter in-vitro zu einer Hemmung dieses Enzyms führt. Mit dem in diesem Schlangengift enthaltenen Pentapeptid BPP5a wurde sogleich eine der wirksamen Komponenten isoliert[1].
Da BPP5a im Körper sehr instabil ist, startete fast gleichzeitig eine Suche nach potenteren und stabileren Inhibitoren des Enzyms. Ein erster Erfolg gelang 1971 mit der Entdeckung der ACE-hemmenden Wirkung des Nonapeptids Teprotid. Die klinische Weiterentwicklung von Teprotid wurde jedoch zwei Jahre später aus mangelndem kommerziellen Interesse seitens der Hersteller eingestellt.
Ebenfalls anfangs der 1970er Jahre konnte die wirksame Teilstruktur der ACE-hemmenden Peptide BPP5a und Teprotid aufgeklärt werden. Anhand dieser Entdeckungen wurden neue nichtpeptidische ACE-Hemmer entwickelt. 1974 wurde erstmalig der ACE-Hemmer Captopril beschrieben, der Produkt einer gross angelegten Wirkstoffsuche (Screening) der Pharmafirma Squibb war[2]. 1981 wurde er als erster ACE-Hemmer in die Therapie eingeführt. Zwei Jahre später folgte mit Enalapril die Markteinführung eines zweiten ACE-Hemmers.
Aufgrund des grossen therapeutischen und wirtschaftlichen Erfolges der Arzneistoffe Captopril und Enalapril wurde eine 2. Generation der ACE-Hemmer entwickelt, die seit Anfang der 1990er Jahre erhältlich sind (z.B. Lisinopril und Ramipril).
Ökonomische Bedeutung
In Deutschland nehmen etwa 20 % der Bevölkerung und jeder zweite über 55 Jahre Arzneimittel zur Behandlung des Bluthochdrucks ein. Etwa 35 % der Bluthochdruckpatienten werden mit einem ACE-Hemmer in Monotherapie und ca. 55 % in Kombination mit einem weiteren Blutdruck senkenden Arzneimittel behandelt.
In den USA wurde im Jahr 2001 114 Millionen Packungen ACE-Hemmer verschrieben. Das entspricht einem Gesamtumsatz von ca. 4,3 Milliarden US-Dollar. Den Hauptanteil daran trägt der ACE-Hemmer Lisinopril (47 %), gefolgt von Enalapril (17 %), Captopril und Ramipril (je 9 %). Auf dem von Generika geprägten deutschen Markt dominiert hingegen der Arzneistoff Enalapril.
Alternativen
Neuere Substanzen aus der Gruppe der AT1-Antagonisten hemmen nicht mehr das Angiotensin Converting Enzyme, sondern wirken antagonistisch auf den Angiotensin-II-Rezeptor-1 Subtyp, so dass Nebenwirkungen möglicherweise seltener auftreten. AT1-Antagonisten sind aber derzeit noch erheblich teurer als ACE-Hemmer und konnten diese bislang nicht ersetzen. Die bessere Verträglichkeit besteht darin, dass sie nicht auf das Bradykinin-System einwirken.
Vasopeptidaseinhibitoren wie Omapatrilat sind von den klassischen ACE-Hemmern abgeleitet und stehen derzeit kurz vor der Zulassung durch die Gesundheitsbehörden. Zusätzlich zur Hemmung des Angiotensin Converting Enzyme hemmen die Vasopeptidaseinhibitoren die neutrale Endopeptidase, ein Enzym, das für die Inaktivierung des blutgefässrelaxierenden atrialen natriuretischen Peptids (ANP) verantwortlich ist.
Ein anderer, neuartiger Angriffspunkt ist die Hemmung des in der Niere gebildeten Enzyms Renin, das für die Synthese von Angiotensin I verantwortlich ist. Mit Aliskiren ist ein selektiver Hemmer dieses Enzyms zugelassen worden, weitere Reninhemmer, wie z. B. Remikiren und Zankiren befinden sich in der klinischen Erprobung.
Intensivmedizinischer Aspekt
Es hat sich in der Intensivmedizin gezeigt, dass Patienten, die vor dem Intensivstationsaufenthalt mit ACE-Hemmern therapiert worden sind, oftmals einen höheren Verbrauch an Katecholaminen aufweisen, um den mittleren arteriellen Druck zu stabilisieren. Grund dafür dürfte ein Vasopressinmangel sein, das auf die vorhergehende Therapie mit ACE-Hemmern zurückzuführen wäre. Durch die Substitution von Vasopressin (ADH), speziell bei Patienten, die sich in einem Katecholamindilemma befinden, kann häufig der Katecholaminbedarf (soweit keine weiteren Gründe für niedrigen Blutdruck vorliegen) rasch reduziert werden und danach das Vasopressin binnen 12–24 Stunden ausgeschlichen werden.
Weiterführende Literatur
- D. W. Cusham, M. A. Ondetti: History of the design of captopril and related inhibitors of angiotensin converting enzyme. in: Hypertension. 17.1991, 589-592
- E. Mutschler, G. Geisslinger, H. K. Kroemer, M. Schäfer-Korting: Therapie der Hypertonie. In: Mutschler E. (Hrsg.): Arzneimittelwirkungen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 82001, 571-587, ISBN 3-8047-1118-9
|
|
Bitte beachten Sie den Hinweis zu Gesundheitsthemen! |
|
|
Dieser Artikel wurde in die Liste der exzellenten Artikel aufgenommen. |
Dieser Artikel stammt aus der freien Enzyklopädie Wikipedia und kann dort eingesehen werden (Autorenliste). Der Artikel steht unter der GNU Lizenz für freie Dokumentation.
Unsere Website dient einzig Informationszwecken. Sie ersetzt keinesfalls die persönliche Untersuchung, Beratung und Behandlung durch Fachkräfte. Bitte beachten Sie auch unsere Rechtlichen Nutzungsbedingungen.
[an error occurred while processing this directive]

