|
Krankheiten: Parkinson |
|
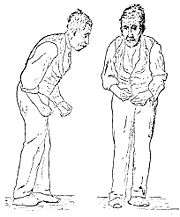
Die Parkinson-Krankheit bzw. Morbus Parkinson (weitere Synonyme: Parkinson′sche Krankheit, Paralysis agitans = Schüttellähmung oder Zitterlähmung, Idiopathisches Parkinson-Syndrom (IPS)) ist eine langsam fortschreitende neurologische Erkrankung. Sie zählt zu den degenerativen Erkrankungen des Extrapyramidalmotorischen Systems. Die vier Hauptsymptome sind Rigor (Muskelstarre), Tremor (Muskelzittern) und Bradykinese (verlangsamte Bewegungen), welche bis hin zu Akinese (Bewegungslosigkeit) führen kann, sowie posturale Instabilität (Haltungsinstabilität). Ausgelöst wird sie durch das Absterben von Zellen in der Substantia nigra, einer Struktur im Mittelhirn, die den Botenstoff Dopamin herstellt. Der Mangel an Dopamin führt letztlich zu einer Verminderung der aktivierenden Wirkung der Basalganglien auf die Grosshirnrinde.
Einordnung
Geschichte
Die Erkrankung wurde erstmals von dem englischen Arzt James Parkinson im Jahre 1817 in der Monographie An Essay on the Shaking Palsy (Eine Abhandlung über die Schüttellähmung)[1] beschrieben. Bereits Parkinson wies auf das langsame Fortschreiten der Erkrankung hin.
Die aktuelle Definition des Parkinson-Syndroms fordert das Kernsymptom der Akinese in Kombination mit wenigstens einem der Kardinalsymptome Rigor, Ruhetremor und instabiler Körperhaltung (posturale Instabilität). Daneben sind verschiedene sensorische, vegetative, psychische und kognitive Störungen möglich.
Systematik
| Klassifikation nach ICD-10 | |
|---|---|
| G20 | Primäres Parkinson-Syndrom |
| ICD-10 online (WHO-Version 2006) |
Parkinson-Syndrome treten bei den folgenden vier Gruppen auf:
- Das familiäre Parkinson-Syndrom
- streng vererbte Formen, selten, benannt nach jeweiligem Genort (z. B. PARK1 usw.)
- Das Idiopathische Parkinson-Syndrom (IPS – Gegenstand dieser Seite)
- mit ca. 75 % häufigstes Parkinson-Syndrom
- Symptomatische (sekundäre) Parkinson-Syndrome
- vaskulär, z. B. bei der zerebralen Mikroangiopathie (Morbus Binswanger)
- medikamenten-induziert (z. B. bei Neuroleptika mit Dopamin-Antagonismus)
- posttraumatisch (z. B. Boxer-Enzephalopathie)
- toxininduziert (z. B. durch Kohlenmonoxid, Mangan, MPTP)
- entzündlich (z. B. nach Enzephalitis Economo, auch bei diffusen Erregerbedingten Gehirnerkrankungen wie der fortgeschrittenen HIV-Enzephalopathie)
- metabolisch (z. B. beim Morbus Wilson)
- Parkinson-Syndrome im Rahmen anderer neurodegenerativer Erkrankungen (atypische Parkinson-Syndrome)
- Multisystematrophie
- Progressive supranukleäre Blickparese
- Kortikobasale Degeneration
- Lewy-Körperchen-Demenz usw. (s. u.)
Häufigkeit
Die Erkrankung beginnt meist zwischen dem 50. und 60. Lebensjahr (Gipfel 58.–62. Lebensjahr), wobei Männer eher betroffen sind als Frauen. Mittlerweile wurde jedoch festgestellt, dass die Tendenz dahin geht, dass Männer und Frauen gleichermassen betroffen sind.
Ein Parkinson-Syndrom kann extrem selten bereits vor dem 40. Lebensjahr auftreten. In der Altersgruppe 40–44 Jahre ist etwa einer von 10.000 Menschen betroffen. Die Manifestationsrate der Erkrankung steigt mit zunehmendem Alter bis etwa zum 75. Lebensjahr, dann nimmt sie wieder ab. Von den über 80-Jährigen sind etwa 1,5–2,0 % von einem Parkinson-Syndrom betroffen. In Deutschland wird derzeit von 300.000–400.000 Betroffenen ausgegangen.
Ursachen
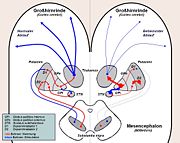
Funktionelle Ebene: Dopaminmangel
Der Morbus Parkinson ist eine degenerative Erkrankung des Extrapyramidalmotorischen Systems (EPS) bzw. der Basalganglien. Dabei kommt es zu einem Absterben von Nervenzellen in der pars compacta der Substantia nigra (auch Nucleus niger, „schwarzer Kern“), die Dopamin herstellen und durch ihre Axone in das Putamen transportieren. Erste Krankheitszeichen fallen erst auf, wenn ca. 70 % dieser dopaminergen Zellen abgestorben sind.
Der Dopaminmangel führt über zwei Wege (s. Bild) letztlich zu einem Ungleichgewicht in der Funktion der Basalganglien. Der Botenstoff Glutamat liegt dabei relativ im Überschuss vor. Dabei hemmt letztlich der Globus pallidus internus die motorische Aktivierung der Hirnrinde durch den Thalamus. Dies führt zu den Kardinalsymptomen Rigor, Tremor und Hypokinese (s. unten), aber auch zur Verlangsamung der geistigen Prozesse (Bradyphrenie).
Neben dem Dopaminmangel wurden auch Veränderungen anderer Neurotransmitter festgestellt. So zeigte sich in einigen Regionen des Hirnstammes ein Serotonin- und Noradrenalin-Mangel.
Zelluläre Ebene
Neuere Forschungen legen den Schluss nahe, dass der Untergang der dopaminproduzierenden Zellen durch eine Überproduktion des Proteins α-Synuclein in diesen Zellen mitverursacht wird.[2] α-Synuclein ist bei gesunden Menschen am Abtransport funktionsfähiger Proteine beteiligt. Das überschüssige α-Synuclein sorgt bei Parkinson-Kranken für eine Unterbrechung der Weiterverarbeitung der Proteinsequenz in ein richtig gefaltetes Protein. Das überschüssige α-Synuclein verhindert auch den Abbau seinesgleichen und verklumpt zu sogenannten Lewy-Körperchen. Die α-Synuclein-Überdosis wird ursprünglich durch einen Gendefekt verursacht, bei dem die Gensequenz zur Produktion von α-Synuclein doppelt oder dreifach vorkommt.
Die Dopamin produzierenden Nervenzellen in der Substantia nigra (auch Nucleus niger, „schwarzer Kern“) sterben an der oxidierenden Wirkung von unverpacktem Dopamin. Durch den Mangel an Dopamin an anderer Stelle (in den Basalganglien) kommt es zu einem relativen Acetylcholinüberschuss. Zudem zeigt sich in einigen Regionen des Hirnstammes ein Serotonin- und Noradrenalinmangel. Die genannten Stoffe dienen als Botenstoffe, sogenannte Neurotransmitter, um Impulse zwischen den Nerven weiterzuleiten. Sind diese Neurotransmitter nicht ausreichend vorhanden, kommt es zu massiven Einschränkungen, hier im Bereich der Motorik, sowie im psychischen, sensorischen und vegetativen Bereich.
In jüngster Zeit wurden Studien publiziert, in denen die Beziehungen zwischen dem Absterben der dopaminergen Nervenzellen in der Substantia nigra und ihrem Neuromelaningehalt untersucht wurden. Struktur und Funktion dieses „Farbstoff des Gehirns“ sind bisher noch unklar; postuliert wird jedoch eine mögliche Beteiligung an den neurodegenerativen Prozessen der Parkinson-Krankheit.[3]
Dass neurotoxische Umweltgifte Ursachen für einen Dopaminmangel sein können, wird bereits seit längerer Zeit erforscht. In einer Studie mit 140.000 Personen fand man nun, dass diejenigen Personen, welche über Kontakt mit Pestiziden berichteten, auch eine 70 Prozent höhere Wahrscheinlichkeit für das Auftreten von Parkinson aufwiesen. Auch Studien am Tier legen eine zerstörende Wirkung von Pestiziden auf dopaminerzeugende Nervenzellen nahe. Das gängige Lösungsmittel Trichlorethylen trägt offenbar ebenfalls zur Entstehung der Parkinson-Krankheit bei. Hinweise darauf fanden Forscher der Universität von Kentucky in Lexington. Demnach hatten 57 Prozent der Probanden, die langjährig mit Trichlorethylen in Berührung kamen, entweder Parkinson oder Parkinson-ähnliche Symptome. Die übrigen Probanden, die nicht so eng mit der Substanz in Berührung kamen, hatten zwar keine klaren Symptome, wiesen aber eine langsamere Feinmotorik auf als gesunde Kontrollpersonen. Gleichzeitig zeigten Studien an Ratten, dass Trichlorethylen die Zellen in der Substantia nigra schädigt, jener Hirnregion, die den Botenstoff Dopamin produziert und deren Schädigung mit der Parkinson-Krankheit einhergeht. Andere Ursachen wie Asbest, Chemikalien, Säuren oder Kohle konnten dagegen ausgeschlossen werden.
Symptome
Die Erkrankung beginnt schleichend und schreitet danach zeitlebens fort, die Symptome werden im Verlauf stärker und daher auch besser erkennbar. Das IPS beginnt typischerweise einseitig (und bleibt im Verlauf einseitig stärker); als Frühzeichen gilt z. B. das reduzierte und später fehlende Mitschwingen eines Armes beim Laufen. Nicht selten treten Schulterschmerzen und einseitige Muskelverspannungen auf, die den Patienten zuerst zum Orthopäden führen.
Kardinalsymptome
Akinese (auch Bradykinese oder Hypokinese)
Diese allgemeine Bewegungsarmut ist Voraussetzung für die Diagnose eines Parkinson-Syndroms. Sie macht sich bei allen Bewegungen bemerkbar. So vermindert sich das Muskelspiel, was den Gesichtsausdruck bestimmt (Maskengesicht, Hypomimie), das Sprechen wird leise und undeutlich (Mikrophonie), das Schlucken verzögert sich (scheinbar vermehrter Speichelfluss – Pseudohypersalivation), die Geschicklichkeit der Hände lässt besonders bei schnellen Bewegungen nach (Schriftbild wird kleiner – Mikrographie), die Rumpfbewegungen sind erschwert (vermindertes Umlagern im Schlaf), das Gangbild wird kleinschrittig und schlurfend.

Zu diesem obligaten Krankheitszeichen muss mindestens eines der folgenden drei Symptome kommen:
Rigor (auch Rigidität)
Damit wird eine Steifigkeit aufgrund einer Steigerung des Muskeltonus bezeichnet. Sie wird durch eine unwillkürliche Anspannung der gesamten quergestreiften Muskulatur hervorgerufen und führt oft auch zu Muskelschmerzen. Nach aussen sichtbar sind eine leichte Beugung von Ellenbogengelenk, Rumpf und Nacken sowie später der Kniegelenke. Bei passiver Bewegung der Gelenke von oberer und unterer Extremität tritt das so genannte Zahnradphänomen auf. Körpernahe Muskelgruppen sind oft stärker betroffen (axialer Rigor). Eine gekrümmte Fehlhaltung des Körperstammes durch die Tonuserhöhung wird als Kamptokormie bezeichnet.
Ruhetremor
Durch wechselseitige Anspannung gegenwirkender Muskeln entsteht ein relativ langsames Zittern (Antagonistentremor – vier bis sechs Schläge pro Sekunde, selten bis neun Schläge pro Sekunde), das bei Bewegung abnimmt. Es ist typisch für das idiopathische Parkinson-Syndrom (75 %) und weniger typisch für atypische Parkinson-Syndrome (25 %), auch der Tremor ist einseitig betont. Der Tremor ist das augenfälligste Symptom, tritt aber auch als essentieller Tremor bei Kleinhirnerkrankungen usw. auf, so dass er zur Fehldiagnose verleiten kann.
Posturale Instabilität
Die verminderte Stabilität beim Aufrechthalten des Körpers kommt durch eine Störung der Stellreflexe zustande. Die kleinen, aber schnellen reflektorischen Ausgleichsbewegungen werden verzögert, so dass es zur Gang- und Standunsicherheit kommt. Die Wendebewegung wird unsicher, die Patienten kommen dabei ins Trippeln. Sie bekommen Angst zu fallen; diese Fallangst kann sie noch zusätzlich zur motorischen Behinderung beeinträchtigen. Bei früh stark gestörten Stellreflexen muss ein atypisches Parkinson-Syndrom bedacht werden.
Die unterschiedlichen Symptome können beim einzelnen Erkrankten unterschiedlich stark ausgeprägt sein oder ganz fehlen, Auftreten und Stärke wechseln auch im Tagesverlauf. Man unterscheidet daher die Verlaufsformen des Morbus Parkinson vom akinetisch-rigiden Typ, vom tremordominanten und vom Äquivalenztyp.
Fakultative Begleitsymptome
Neben diesen Kardinalsymptomen kommt es im Krankheitsverlauf in individuell unterschiedlichem Ausmass zu weiteren Symptomen:
- Sensorische Symptome
- Missempfindungen (Dysästhesien) werden häufig berichtet, ihre Ursache ist aber nicht genauer bekannt.
- Schmerzen treten besonders an Gelenken und Muskeln auf (siehe oben).
- Vegetative Störungen
- Ein Salbengesicht (fett-glänzende Gesichtshaut) entsteht durch gesteigerte Talgproduktion (zusammen mit der Hypomimie).
- Im fortgeschrittenen Krankheitsstadium kommt es zu Kreislaufregulationsstörungen (orthostatische Hypotonie). Nicht selten ist der Blutdruck im Liegen erhöht und sackt dann in aufrechter Körperhaltung ab, so dass die Patienten fälschlicherweise mit Medikamenten gegen hohen Blutdruck behandelt werden. Eine im Verlauf früh auftretende ausgeprägte Blutdruckinstabilität spricht für ein atypisches Parkinson-Syndrom.
- Blasenfunktionsstörungen behindern die Patienten im sozialen Leben erheblich. Meist steht zu Beginn ein plötzlicher starker Harndrang, oft schon bei kleinen Füllmengen (Pollakisurie). Schliesslich schaffen sie es – auch aufgrund der Akinese – nicht mehr rechtzeitig zur Toilette.
- Sexualfunktionsstörungen sind häufig und betreffen sowohl die Libido als auch die Potenz.
- Bewegungsstörungen des Magen-Darm-Trakts können sowohl zu Durchfall als auch Verstopfung führen und die Resorption der Medikamente stark beeinflussen: Durchfall führt zu einer Unterdosierung, weil mehr von den verabreichten Wirkstoffen als pharmakologisch kalkuliert vorzeitig unresorbiert den Körper verlassen. Verstopfung führt zur Überdosierung, weil mehr von den verabreichten Wirkstoffen als pharmakologisch kalkuliert im Körper verbleiben und resorbiert werden; hierbei ergibt sich durch unterschiedliche Plasmahalbwertszeiten der Wirkstoffe zusätzlich eine unerwünschte Verschiebung ihrer Mengenverhältnisse.
- Temperaturregulationsstörungen führen vor allem zu einer verminderten Hitzetoleranz durch eine Störung des reflektorischen Schwitzens und der reflektorischen Gefässerweiterung bei Wärme. Dies kann bei fortgeschrittener Erkrankung zu lebensbedrohlichen hochfieberhaften Zuständen führen. Besonders nachts kommt es zu starken Schweissausbrüchen.
- Im Verlauf frühzeitig auftretende vegetative Störungen weisen eher auf ein atypisches Parkinson-Syndrom.
- Psychische Veränderungen
- Eine niedergedrückte Stimmung kann als Frühsymptom der Diagnose um Jahre vorausgehen. Sie betrifft im Verlauf mindestens 40 Prozent der Patienten.
- Eine klassisch als Bradyphrenie bezeichnete Verlangsamung der Denkabläufe ist Ausdruck der allgemeinen Antriebsstörung. Sie gilt als Pseudodemenz, da das Denken nur verlangsamt, nicht aber inhaltlich beeinträchtigt ist.
- Die Störung der Einschätzung von Entfernungen und Geschwindigkeiten (Visuospatiale Aufmerksamkeit) stellt besonders in Verbindung mit den motorischen Einschränkungen eine Gefährdung im Strassenverkehr dar. Sie entspricht einer Störung im Frontalhirn.
- Sinnestäuschungen sind zumeist Folge der dopaminergen Medikamente. Sie führen zunächst zu benignen (= gutartigen) Halluzinationen, die der Betroffene als Trugbild erkennt. Zum Beispiel werden nicht vorhandene Personen im Raum gesehen. Dieses Symptom tritt erst im späteren Verlauf der Krankheit auf. Bei zusätzlicher Demenz können sich optische und akustische Halluzinationen weiter ausprägen bis hin zu einem meist als äusserst bedrohlich empfundenen szenischen Erleben, z. B. eingekerkert zu sein. In diesem Zustand können die Patienten in panischer Angst aggressiv reagieren, was nicht selten verkannt wird und zu falschen therapeutischen Konsequenzen führt. Das den vor allem auch akustischen halluzinatorischen Sinnestäuschungen dauerhafte Ausgesetztsein kann sich verselbstständigen und zu nachhaltigen psychischen Erkrankungen wie Verfolgungswahn führen. Eine Besonderheit der kognitiven Störungen bei der Parkinson-Erkrankung ist die oft stark fluktuierende Störung der Aufmerksamkeit mit immer wieder luziden (klaren) Augenblicken.
- Eine echte Demenz stellt eine vermutliche Verlaufsform des IPS dar, die Lewy-Körperchen-Demenz.
Die psychischen Veränderungen sind für die Alltagsbehinderung der Parkinson-Patienten von erheblicher Bedeutung und werden oft unterschätzt, da sie nicht so augenfällig sind wie die motorischen Phänomene.
Diagnostik
Die Tatsache, dass die Symptomatik der Parkinson-Krankheit durch L-Dopa positiv beeinflussbar ist (siehe Abschnitt Behandlung), lässt sich diagnostisch nutzen. Beim sog. L-Dopa-Test wird die Schwere der Symptomatik mittels eines standardisierten Tests festgehalten. Nach Gabe einer definierten Menge an L-Dopa wird der Test erneut durchgeführt. Eine signifikante Verbesserung der Symptomatik stützt die Diagnose Parkinson.
Der Test kann auch mit dem Dopaminagonisten Apomorphin durchgeführt werden (Apomorphin-Test).
Behandlung
- siehe auch: Parkinsonmittel
Es gibt heute noch keine Möglichkeit einer ursächlichen Behandlung des Parkinson-Syndroms, die in einem Verhindern oder zumindest einem Aufhalten der fortschreitenden Degeneration der Nerven des nigrostriatalen Systems bestünde. Daher muss man sich mit einer Behandlung der Symptome begnügen, die zunehmend gut möglich ist, was den Patienten, zumindest in den ersten Jahren (manchmal auch Jahrzehnten) der Erkrankung ein nahezu unbehindertes Leben ermöglicht.
Dies geschieht hauptsächlich durch die Gabe von L-Dopa (Levodopa), einer Vorstufe des Dopamins. Dieser ist es – im Gegensatz zum Dopamin selbst – möglich, die Blut-Hirn-Schranke zu durchqueren. Nach mehrjähriger Einnahme von L-Dopa können unwillkürliche Bewegungen, so genannte Fluktuationen, auftreten. Diese erklärt man durch eine pulsatile Rezeptorenstimulation, da L-Dopa nur eine Wirkzeit von wenigen Stunden hat.
Deswegen empfiehlt man in der Regel, besonders bei jüngeren Patienten, beim Beginn der Parkinson-Krankheit die Behandlung mit einem länger wirkenden Dopaminagonisten. Dopaminagonisten ahmen an den Dopamin-Rezeptoren die Wirkung von Dopamin nach.
Mit sogenannten MAO-B-Hemmern (Selegilin, Rasagilin) wird der Abbau von Dopamin im Gehirn verlangsamt.
Anticholinergika werden heute wegen ihres ungünstigen Nebenwirkungsprofils auf die kognitive Leistungsfähigkeit nur noch selten verordnet. Sie spielen allerdings eine Rolle beim durch Neuroleptika induzierten Parkinson-Syndrom.
Hemmstoffe der Catechol-O-Methyltransferase, so genannte COMT-Hemmer (Entacapon, Tolcapon), hemmen den Abbau der Dopaminvorstufe L-Dopa zu inaktiven Metaboliten. Dadurch erhöhen sie bei der gemeinsamen Einnahme mit Levodopapräparaten die Verfügbarkeit von Levodopa um 40 bis 90 Prozent und verlängern seine Plasmahalbwertszeit. Entacapon und Tolcapon dürfen nur in Verbindung mit L-Dopa und einem Decarboxylasehemmer angewendet werden. Diese Kombinationstherapie kann zu Einsparungen bei der Dosierung von Levodopa führen und somit das Nebenwirkungsprofil positiv beeinflussen.
Ebenfalls eingesetzt wird Amantadin, besonders im Rahmen der akinetischen Krise.
Mit dem unaufhaltsamen Fortschreiten der Erkrankung muss die medikamentöse Behandlung im Verlauf immer wieder – durch einen Arzt für Neurologie oder in einer der Parkinson-Fachkliniken – angepasst werden.
L-Dopa-Präparate
L-Dopa-Präparate, von denen es in Deutschland mehr als 20 verschiedene gibt, enthalten immer L-Dopa in Kombination mit einem Decarboxylasehemmer (Carbidopa oder Benserazid), der den Abbau des gegen das Parkinson-Syndrom wirksamen L-Dopa peripher (das heisst im Organismus) hemmt, bevor es die Blut-Hirn-Schranke überwindet. So kommt man mit geringeren L-Dopa-Dosen aus und mit geringeren unerwünschten Wirkungen des Präparats ausserhalb des Gehirns (wie zum Beispiel Herzrhythmusstörungen, Übelkeit, Mundtrockenheit).
Seit wenigen Jahren existiert ein Kombinationspräparat aus L-Dopa, Carbidopa und dem COMT-Hemmer Entacapon. Es ist bei Patienten angezeigt, bei denen zum Ende eines Dosisintervalls Fluktuationen auftreten, die mit einer Kombination aus L-Dopa mit nur einem Decarboxylasehemmer nicht ausreichend stabilisiert sind.
Dopaminagonisten
In der Therapie der Parkinson-Krankheit werden neben dem oben genannten Levodopa auch Arzneistoffe eingesetzt, die Dopamin-Rezeptoren stimulieren und somit eine dem Dopamin analoge Wirkung besitzen. Hierzu zählen die klassischen Mutterkornalkaloide (Bromocriptin, Cabergolin, Dihydroergocryptin, Lisurid und Pergolid) und die neueren selektiven D2-Rezeptoragonisten (Piribedil, Pramipexol, Ropinirol und Rotigotin). Die verschiedenen Präparate unterscheiden sich in ihrer Wirkdauer, im Wirkeintritt, in ihrer Galenik und in ihrem Nebenwirkungsprofil.
Eine weitere Behandlungsmethode stellt Amphetamin (ebenfalls ein Dopamin-Agonist) dar. Es führt zur erhöhten Ausschüttung von Dopamin in den synaptischen Spalt und hemmt dessen Wiederaufnahme in das präsynaptische Neuron.[4]
COMT-Hemmer
COMT-Hemmer sind Arzneistoffe, die das Dopamin und Levodopa abbauende Enzym Catechol-O-Methyl-Transferase kompetitiv hemmen. COMT-Hemmer werden immer in Kombination mit Levodopa eingesetzt. Durch die Hemmung des Abbaus und die Anreicherung von Levodopa in der Peripherie steigt die Aufnahme von Levodopa ins Zentralnervensystem und führt somit dort zu einer gewünschten Erhöhung der Dopaminkonzentration. Vertreter dieser Stoffgruppe sind Entacapon und Tolcapon. Letzteres war wegen schwerer, aber nur vereinzelt auftretender Leberschäden vorübergehend vom Markt genommen worden; es ist aber nach einer erneuten Sicherheitsbewertung von der europäischen Arzneimittelagentur (EMEA) für die Therapie der Parkinson-Krankheit wieder zugelassen worden, allerdings mit der Auflage der ständigen Kontrolle der Leberwerte.
Tiefe Hirnstimulation
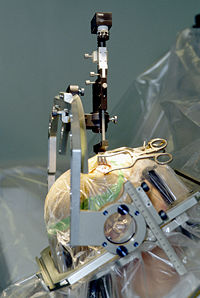
Seit vielen Jahren werden auch neurochirurgische Behandlungsmöglichkeiten eingesetzt. Eine seit Anfang der Neunziger Jahre sehr erfolgreiche Methode ist die Tiefe Hirnstimulation, bei der dem Patienten ein Impulsgenerator („Hirnschrittmacher“) eingesetzt wird[5][6]. Er erzeugt elektrische Impulse und leitet sie über dünne Kabel, je nach Lokalisation der Krankheitsursache und entsprechender Platzierung der Stimulationselektroden, in die jeweiligen Basalganglien Nucleus subthalamicus, Globus pallidus oder den vorderen Thalamus, wodurch dort überaktive Fehlimpulse wirksam unterdrückt werden können. Dieses Verfahren kommt bei Parkinson-Syndromen, daneben aber auch Dyskinesien und essentiellem Tremor in Frage, wenn die medikamentöse Therapie ihre Grenzen erreicht hat oder aus anderen Gründen nicht oder nur eingeschränkt einsetzbar ist.
Bei dem Eingriff zur Elektrodenplatzierung handelt es sich um eine schwierige und nicht ungefährliche Stereotaktische Gehirnoperation, die rund sechs bis zwölf Stunden dauert und sowohl im Vorfeld als auch während der Operation genaueste Planung und Kontrolle anhand von radiologisch gewonnenen räumlichen Bilddaten und elektrisch abgeleiteten neurophysiologischen Messwerten erfordert. Die Wirkung ist zumeist positiv. Es können jedoch eine vorübergehende oder länger andauernde Dysarthrie (Störung der Sprechmotorik) und ein meist auf ein Jahr begrenzter abnorm gesteigerter Antrieb auftreten. Durch die Verletzung der Hirnrinde können in seltenen Fällen auch Epilepsien ausgelöst werden. Ein entscheidender Vorteil der Methode gegenüber früheren „ablativen“ (zerstörenden) Verfahren, die bei diesen Krankheitsbildern heutzutage keine Anwendung mehr finden, liegt allerdings in der nahezu vollständigen Reversibilität.
Die Implantation des batteriebetriebenen Impulsgenerators selbst und dessen Kabelverbindung zur Stimulationselektrode wird in der Regel erst in einem zweiten chirurgischen Eingriff mehrere Tage nach der Elektrodenplatzierung vorgenommen. Das Gerät wird dabei, je nach seiner modellabhängigen Grösse und der Physiognomie des betreffenden Patienten, in einer hierzu präparierten Hauttasche oberhalb des Brustmuskels oder im Bauchraum eingenäht. Nach dem zweiten Eingriff folgt eine Phase in der die Stimulationseinstellungen des Impulsgebers individuell an die Symptome des Patienten angepasst und im Gerät programmiert werden. Sie kann durchaus mehrere Wochen in Anspruch nehmen und während dieser Zeit können auch noch vereinzelt oben genannte Nebenwirkungen (wie Dysarthrie, Dyskinesie, Dystonie) auftreten, weil sich das Gehirn des Patienten erst noch an die Stimulation von aussen „gewöhnen“ muss.
Die Patienten erhalten anschliessend ein spezielles Kontrollgerät, welches ihnen ermöglicht, selbstständig den Ladungszustand der Batterie regelmässig zu überprüfen, den Stimulator bei Bedarf ein- und auszuschalten sowie bei einigen Modellen (nach vorheriger fachlicher Einweisung) auch die Stimulationseinstellungen des Impulsgebers innerhalb bestimmter voreingestellter Grenzbereiche selbst der jeweiligen Situation entsprechend anzupassen. Diese Kontrollgeräte arbeiten transkutan mittels magnetischen Impulsen. Je nach Einstellung des Impulsgenerators und ihrer Kapazität, halten die als Energiespeicher verwendeten Primärzellen („Batterie“) das Gerät etwa zwei bis fünf Jahre kontinuierlich in Betrieb. Sie sind fest im hermetisch gekapselten inerten Titan-Gehäuse des Gerätes eingebaut und somit praktisch untrennbar mit dem Gerät verbunden. Da sie sich deshalb weder einfach austauschen, noch bei den bisher verwendeten Geräten auch transkutan wieder aufladen lassen, ist nach entsprechenden Spannungsverlust durch die mehrjährige kontinuierliche Entladung die korrekte Funktion des Impulsgenerators nicht mehr gewährleistet. Zur Fortsetzung der Tiefen Hirnstimulation ist dann ein weiterer kurzer operativer Eingriff nötig, bei dem das alte Gerät entfernt und durch ein komplett neues ersetzt wird.
Forscher des Forschungszentrums Jülich und der Universität Köln arbeiten an der Entwicklung eines Hirnschrittmachers, der die Parkinson-Symptome nicht nur unterdrücken, sondern sie korrigieren und das Gehirn wieder normal funktionieren lassen soll.[7] Für diese Idee erhielten sie 2005 den Erwin-Schrödinger-Preis.
Implantation fetalen Hirngewebes
Die Implantation embryonaler Stammzellen in das Gehirn konnte zwar Ratten vom Parkinson-Tremor befreien, führte jedoch 2002 bei fünf von 19 Versuchstieren der Harvard Medical School zur Entwicklung unheilbarer Teratome. Der Forschungsansatz wird deshalb kaum noch weiterverfolgt. Vielversprechender sind therapeutische Ansätze mit weiterentwickelten Stammzellen. Dazu zählt der Einsatz neuraler Vorläuferzellen, die aus fetalem Gewebe isoliert worden sind. Sie sind von Wissenschaftlern des Rush-Presbyterian-St. Luke′s Medical Center in Chicago und des Universitätsklinikums Leipzig bereits an Ratten und Affen erfolgreich getestet worden und führten bei ihnen zu keinen negativen Nebenwirkungen. Eine in den USA durchgeführte doppelblind kontrollierte Pilot-Studie zur Wirksamkeit der Transplantation fetaler Vorläuferzellen der Substantia nigra zeigte keinen sicheren Effekt der Transplantationen (Annals of Neurolgy 2003, Olanow et al.). Neben den Komplikationen des Eingriffes selbst scheinen die Fluktuationen zwischen Unbeweglichkeit und Überbewegungen sogar noch zuzunehmen und unvorhersehbarer zu werden.
Nicht medikamentöse Behandlungsverfahren
Ausreichende Bewegung ist wichtig, um die für das Parkinson-Syndrom typische allmähliche Verminderung der Mobilität so lange wie möglich hinauszuzögern. Bei fortgeschrittener Krankheit ist dafür eine speziell darauf ausgerichtete regelmässige Krankengymnastik nötig.
Eine logopädische/sprachtherapeutische Unterstützung ist sinnvoll, wenn sich mit Fortschreiten der Erkrankung das Sprechen (leise und unexakte Aussprache, zu leise und zu hohe Stimme, zu schnelles Sprechen) und/oder das Schlucken (Verschlucken meist zunächst bei Flüssigkeiten, evtl. Komplikationen wie Lungenentzündungen) verschlechtert.
Ergotherapie unterstützt durch Hilfen für den Alltag (z. B. Knöpfhilfen, Greifzangen) und arbeitet an der Raumwahrnehmung zur Verbesserung der Bewegung.
Alternative Behandlungsmethoden
Wie viele Patienten mit unheilbaren Erkrankungen wenden sich auch einige Parkinson-Patienten alternativen Therapien zu. Sie können bei manchen Patienten, wie alle anderen Therapien auch, zu einer subjektiven Besserung führen. Das Fortschreiten der Erkrankung kann damit jedoch nicht aufgehalten werden.
Ausblicke
| Wirkstoff (Markenname) | Wirkmechanismus | Status | Quellen |
|---|---|---|---|
| Isradipin (Antihypertonikum) | Schutz der dopaminbildenden Zellen | Tierversuch | [1] |
| Istradefylline | Hemmung der exzitatorischen Signaltransduktion | klinische Prüfung | PMID 12913186 |
| Spheramine | Implantation dopaminbildender RPE-Zellen | Phase-IIb Studie fehlgeschlagen, Entwicklung eingestellt | [2] |
Eine weitere Behandlungsmöglichkeit ist die Ambulante videounterstützte Parkinsontherapie.
Atypische Parkinson-Syndrome
Es gibt Krankheiten, die der Parkinsonschen Erkrankung ähneln und deren Ursache ebenfalls in einem Verfall von Nervenzellen im Bereich der Basalganglien im Gehirn liegt. Man nennt sie atypische Parkinson-Syndrome oder auch Parkinson-Plus-Syndrome: Menschen, die an diesen Krankheiten leiden, zeigen neben der Parkinson-Symptomatik weitere Symptome. Die häufigsten Krankheiten aus dem Bereich der atypischen Parkinson-Syndrome sind folgende:
- Multi-System-Atrophie (MSA)
- MSA-P Striatonigrale DDegeneration (SND)
- MSA-C Olivopontocerebelläre Atrophie (OPCA)
- Primäre orthostatische Hypotension (Shy-Drager-Syndrom)
- Progressive supranukleäre Blickparese (PSP, auch: Steele-Richardson-Olszewski-Syndrom)
- Kortikobasale Degeneration (CBD)
Die atypischen Parkinson-Syndrome sind vergleichsweise selten. Allerdings gibt es eine hohe Dunkelziffer, eben weil diese Krankheitsbilder selten sind und die Patienten oft fehldiagnostiziert werden (als Morbus Parkinson, Morbus Alzheimer oder auch Depression). In Autopsien stellte sich z. B. die Lewy-Körperchen-Erkrankung (engl. Lewy body disease) als Ursache von ca. 50 Prozent der klinisch als „typisch“ diagnostizierten Parkinson-Syndrome heraus.
Einzelnachweise
- ↑ James Parkinson: An Essay on the Shaking Palsy. Sherwood, Neely, and Jones, London 1817 (Onlinescan der Originalausgabe).
- ↑ Technology Review | Leben | Medizin | Die Kunst der Proteinmanipulation
- ↑ Tribl F., Gerlach M., Marcus K., Asan E., Tatschner T., Arzberger T., Meyer H. E., Bringmann G., Riederer P.: „Subcellular Proteomics“ of Neuromelanin Granules Isolated from the Human Brain. In: Molecular & Cellular Proteomics, 2005, 4(7): 945–957
- ↑ Silbernagl, Stefan; Lang, Florian: Taschenatlas der Pathophysiologie. Thieme Verlag 1998, Stuttgart, New York. S. 312f
- ↑ Charité – Klinik für Neurologie, AG Bewegungsstörungen: „Hirnschrittmacher“ gegen die Parkinson-Erkrankung – Eine Patientenaufklärung (Kupsch, A.; Ulm, G.; Funk, T.) [PDF]
- ↑ dPV e. V. – „Club U40 im Internet“: Hirnschrittmacher gegen die Parkinson-Erkrankung (Kupsch, A.; Ulm, G.; Funk, T.)
- ↑ Handelsblatt: Gezielt aus dem Takt gebracht
|
|
Bitte beachten Sie den Hinweis zu Gesundheitsthemen! |
Dieser Artikel stammt aus der freien Enzyklopädie Wikipedia und kann dort eingesehen werden (Autorenliste). Der Artikel steht unter der GNU Lizenz für freie Dokumentation.
Unsere Website dient einzig Informationszwecken. Sie ersetzt keinesfalls die persönliche Untersuchung, Beratung und Behandlung durch Fachkräfte. Bitte beachten Sie auch unsere Rechtlichen Nutzungsbedingungen.
[an error occurred while processing this directive]

