|
Krankheiten: Insulin |
|
| Insulin | ||
|---|---|---|
|
|
||
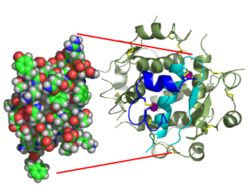
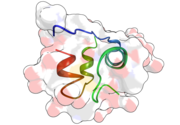
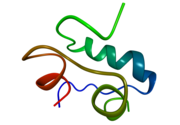
| Zwei Modelldarstellungen des Insulinmoleküls. Links ein Kalottenmodell aus dem die Oberflächenform hervorgeht, rechts ein Modell, bei dem die innere Struktur deutlich wird. Beim letzteren sind α-Helices durch Schrauben und β-Faltblätter durch Pfeile dargestellt. | ||
| Vorhandene Strukturdaten: 1ai0, 1aiy, 1aph, 1b17, 1b18, 1b19, 1b2a, 1b2b, 1b2c, 1b2d, 1b2e, 1b2f, 1b2g, 1b9e, 1ben, 1bph, 1cph, 1dph, 1ev3, 1ev6, 1evr, 1fu2, 1fub, 1g7a, 1g7b, 1guj, 1hiq, 1hit, 1hls, 1htv, 1iza, 1izb, 1j73, 1jca, 1jco, 1lph, 1m5a, 1mhi, 1mhj, 1mpj, 1mso, 1os3, 1os4, 1q4v, 1qiy, 1qiz, 1qj0, 1rwe, 1sf1, 1t0c, 1trz, 1tyl, 1tym, 1uz9, 1w8p, 1wav, 1xda, 1xgl, 1xw7, 1zeg, 1zeh, 1zni, 1znj, 2a3g, 2aiy, 2bn1, 2bn3, 2c8q, 2c8r, 2g4m, 2g54, 2g56, 2hiu, 2ins, 2omg, 2omh, 2omi, 2tci, 3aiy, 3ins, 3mth, 4aiy, 4ins, 5aiy, 6ins, 7ins, 9ins | ||
| Grösse | 51 Aminosäuren; | |
| Struktur | Heterodimer (21 + 30 aa) | |
| Precursor | Präproinsulin | |
| Bezeichner | ||
| Symbol | INS | |
| Externe IDs | OMIM: 176730 UniProt: P01308 MGI: 96573 CAS-Nummer: 9004-10-8 | |
| Arzneistoffangaben | ||
| ATC-Code | A10AB01 | |
| DrugBank | DB00030
|
|
| Verschreibungspflicht | ja | |
| Vorkommen | ||
| Homologie-Familie | HBG006137 | |
| Übergeordnetes Taxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 3630 | 16334 |
| Ensembl | ENSG00000129965 | ENSMUSG00000000215 |
| UniProt | P01308 | Q5EEX1 |
| Refseq (mRNA) | NM_000207 | NM_008387 |
| Refseq (Protein) | NP_000198 | NP_032413 |
| Genlocus | Chr 11: 2.14 - 2.14 Mb | Chr 7: 142.49 - 142.49 Mb |
| PubMed Suche | [2] | [3] |

Insulin ist ein für Menschen und alle Tiere lebenswichtiges Peptidhormon, das in den β-Zellen der Bauchspeicheldrüse gebildet wird. Diese spezialisierten Zellen befinden sich nur in den Langerhansschen Inseln. Von diesen Inseln leitet sich auch der Name Insulin ab (lat. insula).
Einführung
Die Regulation der Traubenzuckerkonzentration (Glukose) im Blut erfolgt durch einen Regelkreis aus zwei Hormonen, die in Abhängigkeit von der Blutzuckerkonzentration ausgeschüttet werden. Das Insulin ist das einzige Hormon, das den Blutzuckerspiegel senken kann. Sein Gegenspieler ist das Glucagon, dessen Hauptaufgabe es ist, den Blutzuckerspiegel zu erhöhen. Auch Adrenalin, Kortison und Schilddrüsenhormone haben blutzuckersteigernde Wirkungen.
Der Blutzuckerspiegel steigt vor allem nach der Aufnahme kohlenhydratreicher Nahrung an. Als Reaktion darauf wird von den β-Zellen Insulin ins Blut ausgeschüttet. Die Hauptwirkung des Insulins für die rasche Senkung der Blutzuckerkonzentration ist seine „Schlüsselfunktion“ für den Transport von Glukose aus dem Blutplasma und aus der Gewebsflüssigkeit in das Zellinnere. Vor allem die Leber- und Muskelzellen können in kurzer Zeit grosse Mengen von Glukose aufnehmen und sie in der Folge entweder in Form von Glykogen speichern oder in Energie umwandeln (siehe Glykolyse).
Auch auf andere Arten von Zellen wirkt Insulin, es hat Einfluss auf den Fett- und Aminosäurestoffwechsel sowie auf den Kaliumhaushalt.
Insulin spielt eine wesentliche Rolle bei:
- Diabetes mellitus
- Insulinresistenz
- Metabolisches Syndrom
- Hyperinsulinismus
- Insulinom
Vorkommen
Über die Unterschiede in der chemischen Struktur der Insuline des Menschen und einiger Säugetiere und die Struktur von künstlich hergestellten Insulinen siehe Insulinpräparat.
Bildung, Speicherung und Freisetzung
Biosynthese
Die Synthese des Insulins erfolgt in den β-Zellen der Langerhansschen Inseln der Bauchspeicheldrüse.
Die mRNA wird zunächst im endoplasmatischen Retikulum (ER) in das Präproinsulin translatiert, das aus 107 Aminosäuren besteht.
Die weitere Prozessierung erfolgt in zwei Schritten, nach der Faltung des Moleküls durch Bildung von Disulfidbrücken entsteht durch Abspaltung von Signalpeptid und C-Peptid das Insulinmolekül.
|
1) Die Abbildung zeigt das Präproinsulin-Molekül mit 110 Aminosäuren, bestehend aus:
2) Faltung
3) das gefaltete Präproinsulin-Molekül. 4) Abspaltung von Signalpeptid und C-Peptid:
5) das Insulin-Molekül:
|
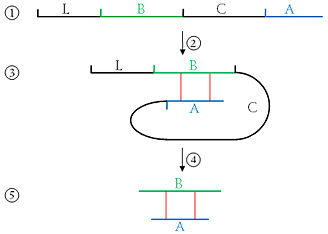
Prozessierung des Präproinsulin zum Insulin.
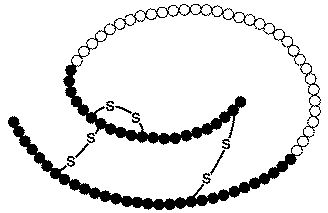
Schematische Darstellung (Topologiemodell) von Proinsulin und Insulin (schwarz); es fehlt das Signalpeptid des Präproinsulins
|
Speicherung
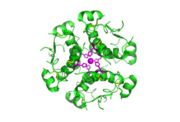
Die Insulinmoleküle werden in den Vesikeln des Golgi-Apparats, der an der Zellmembran der β-Zelle liegt, durch Zink-Ionen zu Hexameren gebunden und so stabilisiert gespeichert.
Die hohe Bindungsfreudigkeit von Insulinmolekülen an Zink hat mehrere wichtige Auswirkungen. Insulin ist in der Form von Hexameren nicht wirksam, auch nach dem Zerfall in Dimere noch nicht, sondern erst als Einzelmolekül. Diese Eigenschaft spielt bei den Insulinpräparaten eine wichtige Rolle. Bei schnellwirkenden Insulinpräparaten ist der zu langsame Zerfall der Molekülverbände unerwünscht und es wird nach Möglichkeiten gesucht, den Zerfall zu beschleunigen. Bei langwirkenden Insulinpräparaten wird die Zinkbindung zur Verlängerung der Wirkdauer durch hohe Zinkkonzentrationen gezielt verstärkt. Bei der Entwicklung von oralen Insulinpräparaten wird die Zinkbindung zur Kopplung von Insulin an Transportmoleküle genutzt.
Ausschüttung

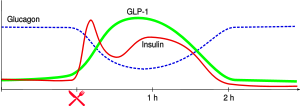
Der wichtigste direkte Reiz zur Ausschüttung des Insulins aus der ss-Zelle ist ein steigender Blutzuckerspiegel (ab ca. 5 mmol Glucose/l Blut). Daneben wirkt die Anwesenheit verschiedener Aminosäuren, freier Fettsäuren und einiger Hormone stimulierend auf die Insulinfreisetzung.
Durch die Hormone Gastrin, Sekretin, GIP und GLP-1 wird die ss-Zelle ebenfalls angeregt, Insulin auszuschütten; sie sind sogar für den Grossteil der Insulinausschüttung nach Nahrungsaufnahme verantwortlich. Siehe Inkretin-Effekt.
Die Insulinausschüttung erfolgt oszillierend. Alle 3 bis 6 Minuten wird Insulin in die Blutbahn abgegeben.
Nach der Nahrungsaufnahme ist bei Stoffwechselgesunden ein biphasischer Verlauf der Insulinsekretion feststellbar: Der erste "Insulinpeak" hat seine Spitze nach 3 bis 5 Minuten und dauert nur ca. 10 Minuten. Danach schliesst eine zweite Phase an, die so lange anhält, wie eine Hyperglykämie besteht.[2] Die erste Phase besteht aus den gespeicherten Insulinmolekülen, die zweite Phase vor allem aus neu gebildetem Insulin.[3]
Glukosegesteuerter Freisetzungsmechanismus
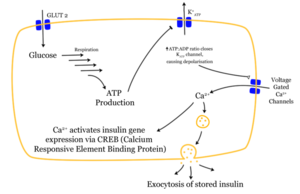
Das Eindringen eines Glukose-Moleküls in die β-Zelle setzt eine Wirkungskette in Gang. Nachdem die Glukose durch den GLUT2-Transporter in die Zelle gelangt ist, wird sie durch Glykolyse verstoffwechselt. Das dabei entstehende ATP hemmt den Ausstrom von Kalium-Ionen. So kommt es durch den stark verminderten Kaliumausstrom zur Depolarisation. Das depolarisierte Membranpotenzial bewirkt eine Öffnung spannungsabhängiger Kalzium-Kanäle. Der Einstrom der Kalziumionen ist der entscheidende Reiz für die Verschmelzung der insulinhaltigen Vesikel mit der Zellmembran (Für Details siehe Blutzucker-Sensorsystem).
Die gespeicherten Insulinmoleküle werden durch Verschmelzen der Membranen (Exozytose) aus den β-Zellen in den Extrazellularraum und weiter in den Blutkreislauf freigesetzt. Dabei werden die Speicher-Hexamere aufgetrennt. Der Insulinspiegel im Blut steigt an.
Halbwertszeit und Abbau
Die biologische Halbwertszeit einzelner Insulinmoleküle im Blutkreislauf liegt bei circa fünf Minuten.[2]
Das Insulin wird über manche Insulinrezeptoren in die Zellen aufgenommen, dort abgebaut und somit verbraucht. In der Leber und in der Niere wird Insulin durch Insulinase inaktiviert; die Insulinase oder genauer Glutathion-Insulin-Transhydrogenase spaltet die Disulfidbrücken zwischen der A- und der B-Kette auf, wodurch das Insulin in zwei Teile zerfällt und wirkungslos wird.[4] Die Abbauprodukte werden durch die Niere ausgeschieden, ebenso ca. 1,5 % des noch intakten Insulins.[5]
Die kurze Zeitspanne der Aktivität des Insulins zeigt, dass die physiologische Steuerung des Zuckerstoffwechsels im gesunden Körper sehr schnell funktioniert; diese Geschwindigkeit kann bei der Behandlung des Diabetes mellitus praktisch nicht erreicht werden.
Wirkungen
Insulinrezeptor
Das im Blut zirkulierende Insulin entfaltet seine Wirkung durch Bindung an Insulinrezeptoren.
Diese werden von nahezu allen Zellen in unterschiedlicher Anzahl exprimiert. Die roten Blutkörperchen exprimieren beispielsweise nur wenige hundert Rezeptoren, Leberzellen und Fettzellen dagegen mehrere Hunderttausend.
Die Insulinrezeptoren sind innerhalb der Zellmembran lokalisiert und gehören somit zur Gruppe der Transmembranrezeptoren bzw. integralen Membranproteine.
Es handelt sich in diesem Fall um ein Hetero-Tetramer, welches aus je 2 α- und β-Untereinheiten zusammengesetzt ist: einer extrazellulären α-Untereinheit und einer die Zellmembran durchspannenden β-Untereinheit, von der sich ein grosser Teil im Zellineren befindet. Die α- und β-Untereinheiten sind jeweils durch Disulfidbrücken kovalent miteinander verbunden. Die β-Untereinheiten besitzen eine sogenannte Tyrosinkinase-Aktivität. Das heisst, dass sie in der Lage sind, Tyrosinreste zu phosphorylieren. (Eine Serinkinase kann folglich Phosphatgruppen auf Serinreste übertragen. Proteinkinase A phosphoryliert Ser- und Thr-Reste) Die Phosphatgruppe stammt dabei von einem ATP-Molekül.[6]
Wenn ein Insulinmolekül von den beiden α-Untereinheiten gebunden wird, kommt es zu einer Konformationsänderung. Die beiden β-Untereinheiten nähern sich einander an und phosphorylieren sich gegenseitig. Daher handelt es sich nicht um eine Autophosphorylierung. Die Kinase-Domänen der β-Untereinheiten erfahren durch die Phosphorylierung eine Konformationsänderung und werden dadurch aktiviert..[6]
Hat die Tyrosinkinase des Insulin-Rezeptors nach Insulinbindung und Aktivierung ihren aktiven Zustand eingenommen, werden mehrere Rezeptoruntereinheiten nahe der Kinasedomäne phosphoryliert und stellen nun Bindungsstellen für intrazelluläre Substrate (z.B. Insulinrezeptorsubstrate, IRS) dar. IRS sind sog. Adapterproteine zwischen dem Insulinrezeptor und dem Protein, das die Signalkaskade weiterleitet (zB. Phosphoinosidkinase-3)..[6]
Letztlich löst die Bindung von Insulin an seinen Rezeptor eine Reihe von Kinase-Kaskaden (Kaskade von Phosphorylierungsreaktionen) aus, die durch Signalwege beschrieben werden können..[6]
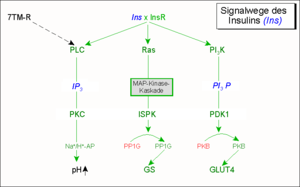
Signalwege
Das Insulinsignal wird über oben genannte Adapterproteine durch die Bildung von Signalkomplexen an verschiedene intrazelluläre Signalkaskaden gekoppelt. Drei Hauptkaskaden verbreiten das durch den Insulinrezeptor erzeugte Signal, der PLC/IP3-Signalweg, der MAP-Kinase-Signalweg und der PI3K-Weg. Diese Signalwege stossen vielfältige Prozesse in der Zelle an, wie beispielsweise die rasche Glucoseverarbeitung, die Lipid- und Protein-Verstoffwechselung, wie auch die dazu notwendige Genexpression.[7]
|
|
Die drei geschilderten Wege bewirken also ein Sinken des Blutglucosespiegels durch
- Förderung der Glucose-Aufnahme (GLUT4-Translokation zur Zelloberfläche)
- Förderung der Glucose-Speicherung (Glykogen-Synthese) in der Leber und den Muskeln
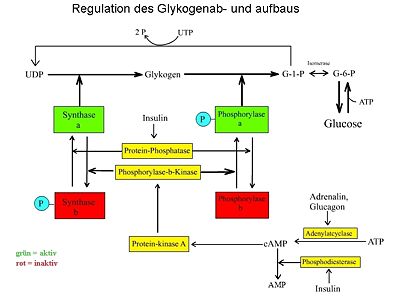
Dieses Signal wird durch Anschalten Glucose-verbrauchender Wege beantwortet. Unterstützende Massnahmen bestehen im Abschalten Glucose-liefernder Wege, so zum Beispiel durch Abbau des second messenger cAMP über eine Phosphodiesterase.
Glukoseaufnahme im Muskelgewebe
Insulin erhöht in der Muskulatur und im Fettgewebe die Permeabilität (Durchlässigkeit) der Zellmembran für Glucose. Dabei ist zu beachten, dass nicht die Membran selbst permeabler wird, sondern dass vermehrt Carrier-Proteine für Glucose aktiviert werden. Dieses Carrier-Protein ist GLUT4, ein hochaffiner, insulinabhängiger Glucose-Transporter, welcher die Glucose durch erleichterte Diffusion (passiver Transport) in die Zelle transportiert. Folgende physikalische Eigenschaften sind für GLUT4 relevant: sättigbar, nicht aktivierbar bzw. inaktivierbar d.h. Regulation nur durch insulinabhängigen Einbau bzw. Ausbau.
Glukoseaufnahme im Gehirn
Nervenzellen (und Erythrozyten) nehmen Glucose insulinunabhängig auf. Bei einer Insulinüberdosis nehmen die insulinabhängigen Zellen mehr Glucose auf und für die insulinunabhängigen bleibt weniger übrig. Im Allgemeinen besteht bei Hypoglykämie die Gefahr, dass das Nervensystem beschädigt wird.
Auf- und Abbau von Fettgewebe
Insulin hemmt die Lipolyse im Fettgewebe und somit den Abbau von Fett.
Förderung des Zellwachstums
Eine weitere zentrale Funktion des Peptidhormons Insulin besteht in der Regulation von Zellwachstum und Proliferation durch die Aktivierung der Transkription von Genen, die für Kontrolle und Ablauf des Zellzyklus von grosser Bedeutung sind. Diese Insulinwirkung ist bei Diskursen über Insulinpräparate ein Thema.
Tryptophan-Aufnahme im Gehirn
Höhere Insulinspiegel haben einen leicht steigernden Einfluss auf die Aufnahme von Tryptophan ins Gehirn.[8]
Insulin und die Regelung des Blutzuckerspiegels
Eine der wichtigsten biologischen Wirkungen des Insulins ist die rasche Beschleunigung der Glucoseaufnahme in Muskel- und Fettzellen und Regulierung der Zwischenspeicherung in der Leber im Rahmen der Regelung des Blutzuckerspiegels:
Die metabolischen und mitogenen Effekte von Insulin werden über die Bindung an dessen Rezeptor auf der Zelloberfläche der Zielgewebe Leber, Muskel und Fett initiiert.
|
|
Gegenspieler
Fällt der Blutzuckerspiegel im Körper unter einen Wert von 80 mg/dl ab, wird die Insulinproduktion bereits stark reduziert.
Sinkt der Blutzucker weiter ab, treten verschiedene Gegenspieler des Insulins auf:
- Glucagon
- Adrenalin
- Kortisol
- Somatotropin
Die Spiegel dieser gegenregulierenden Hormone steigen bereits deutlich an, wenn der Blutzucker unter 60 mg/dl absinkt.
Beim Typ 1 Diabetes ist oft auch der Gegenregulationmechanismus gestört, was zu zusätzlichen Problemen mit Hypoglykämien führt.
Somatostatin hat einen hemmenden Einfluss auf die Sekretion von Insulin und Glucagon, da er als allgemeiner Hemmer im Körper fungiert.
Arzneistoff

- Hauptartikel: Insulinpräparat, Insulintherapie
In der Insulintherapie werden verschiedene Insulinpräparate verwendet. Die wichtigste und am längsten verwendete Verabreichungsart ist die Injektion. Neueren Datums sind Präparate zur Inhalation, derzeit ist aber kein Inhalationspräparat mehr auf dem Markt. Oral gegeben ist Insulin unwirksam, da die Eiweissketten im Magen-Darm-Trakt von körpereigenen Enzymen abgebaut werden, bevor sie ihre Wirkung entfalten können. Es gibt aber Entwicklungen, Insulinmoleküle in Nanopartikel einzuschliessen und so das Insulin "unverdaut" in den Blutkreislauf einzuschleusen.[9]
Insulin steht auf der Liste der verbotenen Doping-Substanzen[10], da es in mehreren Bereichen missbraucht wird. Da Insulin der durch Somatotropin verringerten Glukoseaufnahme in die Muskelzellen entgegen wirkt, wird es oft zur Kompensation dieser unerwünschten Nebenwirkung verwendet (siehe auch Anabolikum). Andere Anwendungen sind die Förderung der Füllung der Glykogenspeicher bei Ausdauersportlern und die Unterstützung des Aufbaus von Muskelmasse.[11]
In der Vergangenheit gab es Versuche, Insulin im Rahmen so genannter Insulinschocktherapien zur Behandlung psychischer Krankheiten einzusetzen. Dieses Verfahren wird heute jedoch nicht mehr praktiziert.
Zeittafel zur Forschungsgeschichte
- Hauptartikel: Geschichte der Diabetologie
1906 - Der deutsche Internist Professor Ludwig Zuelzer führte am 21. Juni 1906 erstmals eine Injektion mit einem von ihm isolierten und von der Firma Schering hergestelltem Kälberpankreasextrakt namens Acomatol am Menschen durch.
| 1869 | - Paul Langerhans entdeckt die Inselzellen im Gewebe der Bauchspeicheldrüse. |
| 1889 | - Oskar Minkowski und Joseph von Mering entfernen an Hunden die Bauchspeicheldrüse und lösen dadurch Diabetes mellitus aus. Kurz darauf werden die Inselzellen als endokrines (hormon-produzierendes) Gewebe vermutet. |
| 1909 | - taucht erstmals der Begriff Insulin „von den Inseln“ kommend auf. |
| 1916 | gelang es Nicolae Paulescu erstmals, Insulin aus Pankreasgewebe zu gewinnen. |
| 1921 | gelang auch Frederick Banting und Charles Best die Extraktion von Insulin, sie nannten es „isletin“. |
| 1923 | erhielten Frederick Banting und John James Richard Macleod den Nobelpreis für Physiologie oder Medizin für die Entdeckung des Insulins. |
| 1928 | gelang Oskar Wintersteiner der Nachweis, dass Insulin ein Protein ist. |
| 1958 | - Der Nobelpreis geht an Frederick Sanger für seine Arbeiten über die Struktur der Proteine, besonders des Insulins. |
| 1963 | gelang Professor Helmut Zahn und seinem Team die weltweit erste chemische Synthese des Insulins. |
| 1982 | gelang es erstmals, Humaninsulin durch gentechnisch veränderte Bakterien in grosser Menge herzustellen. |
| 1996 | - Lyspro/Humalog war das erste schnellwirkende Insulinanalogon. |
Dieser Artikel stammt aus der freien Enzyklopädie Wikipedia und kann dort eingesehen werden (Autorenliste). Der Artikel steht unter der GNU Lizenz für freie Dokumentation.
Unsere Website dient einzig Informationszwecken. Sie ersetzt keinesfalls die persönliche Untersuchung, Beratung und Behandlung durch Fachkräfte. Bitte beachten Sie auch unsere Rechtlichen Nutzungsbedingungen.
[an error occurred while processing this directive]